Хлорная кислота – сильный окислитель

Понятие

Хлорная кислота представляет собой однокомпонентную безводную кислоту, которая считается одной из самых мощных и потенциально опасных химических субстанций. Она содержит хлор с высоким уровнем окисления, что делает её крайне эффективным окислителем. Соли этой кислоты также используются в качестве окислителей.
- Определение: Хлорная кислота (HClO) – слабая кислота, содержащая хлор и кислород.
- Химические свойства: Обладает окислительными свойствами, реагирует с металлами, органическими соединениями и щелочами.
- Производство: Получается путем реакции хлора с гидроксидом натрия или калия.
- Применение: Используется в очистке воды, в производстве отбеливателей и дезинфекторов.
- Безопасность: Является коррозионным и токсичным веществом, требует соблюдения мер предосторожности при использовании.
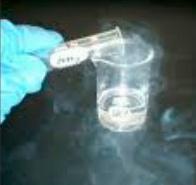
Как химическое соединение, хлорная кислота является бесцветной летучей жидкостью, обладающей гигроскопическими свойствами. При взаимодействии с воздухом она поглощает воду, начинает дымиться (образуя моногидрат), постепенно изменяет цвет и может самопроизвольно взрывать. Раствор хлорной кислоты в воде имеет маслянистую консистенцию и обладает пониженной окислительной мощностью, легко воспламеняется.
Свойства хлорной кислоты:
— обладает сильным дымлением при контакте с окружающей средой; — нестабильна; — хорошо растворима в органических и хлорсодержащих растворителях, а В этаноле; — смешивается с водой в любых пропорциях; — способна растворять золото, металлы платиновой группы, серебро и др.; не взаимодействует с бромом; — взрывоопасна при контакте со спиртом, бумагой и древесиной.
Хлорная кислота, или соляная кислота, представляет собой один из наиболее распространённых и важных химических реагентов. Она обладает высокой коррозионной активностью и способна реагировать с большинством металлов, образуя соответствующие соли и выделяя водород. Одной из ключевых особенностей хлорной кислоты является её способность образовывать ассоциации с водой, что обуславливает её использование в различных концентрациях в зависимости от необходимости. При этом в реакциях с основами или щелочами происходит нейтрализация, что приводит к образованию солей, которые могут быть использованы в разных отраслях химической промышленности.
Применение хлорной кислоты охватывает широкий спектр, начиная от металлообработки и заканчивая производством химических соединений. Она часто используется в процессе очистки металлических поверхностей от ржавчины и оксидов, что существенно улучшает адгезионные свойства и повышает срок службы изделий. Кроме того, хлорная кислота находит своё применение в пищевой промышленности, где она используется для регулирования кислотности и в качестве консервирующего агента. Эта универсальность делает хлорную кислоту незаменимым компонентом в различных технологических процессах.
Нельзя забывать и о мерах безопасности при работе с хлорной кислотой, так как она является высокотоксичным и опасным веществом. Обеспечение надлежащих условий хранения и обработки, использование защитных средств и регулярное обучение персонала являются важными аспектами работы с этим реактивом. Соблюдение этих правил не только защитит здоровье работников, но и предотвратит возможные экологические последствия, которые могут возникнуть в результате неправильного обращения с хлорной кислотой.
Получение
Раствор данной кислоты получают путем электрохимического окисления соляной кислоты или хлора, которые находятся в высокой концентрации в хлорной кислоте, с использованием специализированного лабораторного оборудования. Безводную форму вещества можно получить при реакции перхлората калия или натрия с концентрированным раствором серной кислоты. Этот метод получил свое распространение в начале XIX века и продолжает использоваться по сей день.
Применение
Основные области применения хлорной кислоты: — химическая промышленность (при производстве взрывчатых веществ и осушителей).
— аналитическая химия (для получения перхлоратов); — горнодобывающая отрасль (катализатор в процессе разложения руд и исследования минералов);
Меры предосторожности и правила работы
При работе с хлорной кислотой, как и с другими агрессивными химическими веществами, нужно проявлять крайнее внимание к мерам безопасности. Для избежания прямого контакта с кислотой все эксперименты, исследования и прочие работы должны проводиться в:- респираторах и противогазах (для защиты органов дыхания); — защитных очках; — нитриловых перчатках; — специальной защитной одежде (фартуки, бахилы) и других резинотехнических изделия.
При транспортировке и хранении следует следовать определенным предписаниям: безводная кислота имеет ограниченный срок годности, поэтому её нельзя хранить длительное время, так как она нестабильна и под обычными условиями может быстро разлагаться. Это может вызвать непреднамеренные взрывы. Хранить необходимо отдельно от других кислот и металлов, которые могут с ней реагировать. Помещение для хранения должно быть свободным от источников тепла и защищено от попадания солнечных лучей.
Опасность для организма
Некоторые кислоты оказывают полезное влияние на организм, участвуя в метаболических процессах, и их нехватка может вызвать серьезные проблемы со здоровьем. Однако это не относится к хлорной кислоте, которая даже при минимальном контакте способна вызывать химические ожоги, повреждая кожу и слизистые оболочки.
Где приобрести химические реактивы с гарантией качества?
Товары высокого европейского качества – это неоспоримая гарантия надежных результатов!
Вопросы по теме
Каковы основные способы хранения и безопасного обращения с хлорной кислотой?
Хлорная кислота должна храниться в специальных контейнерах, устойчивых к коррозии, таких как полиэтиленовые или стеклянные емкости. Главное — избегать металлических сосудов, так как кислота может вызывать коррозию. Хранение должно осуществляться в хорошо вентилируемом помещении, вдали от источников тепла и прямых солнечных лучей. Также важно следовать мерам предосторожности, используя защитные средства (перчатки, очки, маски) при работе с данной кислотой, чтобы избежать контакта с кожей и слизистыми оболочками.
Какие реакции происходят при взаимодействии хлорной кислоты с металлами, и какие продукты образуются?
При взаимодействии хлорной кислоты с металлами происходит процесс окисления, в результате которого образуются соли, называемые хлоридами, и водород. Например, при реакции с цинком будет получен хлорид цинка и водород: Zn + 2 HCl → ZnCl2 + H2. Эта реакция широко используется в лабораторных условиях и промышленности для выделения водорода.
Есть ли какие-либо экзотические применения хлорной кислоты в современной технологии?
Да, хлорная кислота находит применение не только в традиционной химии, но и в высоких технологиях. В частности, она используется в производстве полупроводников, где необходима высококачественная очистка кремниевых пластин. Кроме того, в биомедицинских исследованиях хлорная кислота может быть использована для синтеза некоторых лекарственных препаратов и в качестве реактива для выявления определенных биомолекул. Это открывает новые горизонты для применения хлорной кислоты в научных и промышленных исследованиях.